Этиология и течение пневмоний у гематологических больных
Инфекционные поражения легких — частые осложнения у онкогематологических больных, которые могут быть обусловлены бактериями, грибами, вирусами, простейшими. Они обнаруживаются у 19-70% пациентов и нередко определяют прогноз заболевания. У многих больных в процессе лечения пневмонии возникает острая дыхательная недостаточность (ОДН), что является причиной перевода в реанимационное отделение каждого четвертого пациента. Смертность среди этих больных за последние 5 лет существенно не изменилась и достигает 85%. Летальность может быть снижена в результате своевременной и точной диагностики причин поражения легких. Однако данные о чувствительности и специфичности таких методов у иммунокомпрометированных больных с поражениями легких противоречивы.
Обследование гематологических больных сопряжено с рядом трудностей. К ним относят:
• скоротечность легочного поражения, поэтому обследование должно быть выполнено в сжатые сроки (7-10 суток, а при развитии ОДН — в течение 2-3 суток);
• появление геморрагического синдрома, обусловленного тромбоцитопенией, что затрудняет проведение инвазивных методов диагностики;
• инфицированность нетипичными возбудителями легочной инфекции, которые редко встречаются у пациентов без онкогематологических заболеваний, что порой составляет трудности при их верификации.
У больных острыми лейкозами при проведении индукционной химиотерапии вероятность бактериальных и грибковых пневмоний увеличивается с возрастом. Бактериальные пневмонии осложняют течение постцитостатического периода у 19—22% больных острым лейкозом и у 21% больных после трансплантации гемопоэтических стволовых клеток. К факторам риска возникновения пневмоний относят также лечение иммуносупрессивными препаратами, высокодозную химиотерапию. Установлена зависимость между глубиной, длительностью лейкопении и частотой инфекционных осложнений, смертностью от них. Миелотоксический агранулоцитоз является одним из важнейших факторов, предрасполагающих к развитию бактериальных и грибковых поражений легких. Для пневмоцистных пневмоний фактором риска является наличие лимфопролиферативных заболеваний.
Для больных острым лейкозом в период интенсивной нейтропении возбудителями инфекции легких обычно бывают грамотрицательные палочки (в основном Е. coli, Р. aeruginosa, К. pneumoniae) и грамположительные кокки (S. epidermidis, Streptococcus spp.), которые колонизируют больного (более 50% из них являются госпитальными). Часто в этот период времени возникает реактивация вируса простого герпеса. У больных, нуждающихся в повторном курсе химиотерапии, «госпитальные» пневмонии часто бывают вызваны резистентными грамотрицательными штаммами, может наблюдаться массивная колонизация грибами рода Candida, Aspergillus spp.
Пневмонии у больных с множественной миеломой вне химиотерапии часто обусловлены S. pneumoniae. Другими возбудителями инфекции легких могут являться Н. influenzae, N. meningitidis, Е. coli и пр. При прогрессировании заболевания отмечается превалирование грамотрицательных бактерий. Аналогичная ситуация наблюдается, если химиотерапия миеломы становится более агрессивной. В этом случае возможно развитие грамотрицательной бактериальной, кандидозной, аспергиллезной пневмонии. Большинство инфекций при хроническом лимфолейкозе связаны с бактериальной инвазией верхних и нижних дыхательных путей (синуситы, отиты, пневмонии). Преобладают S. pneumoniae, другие инкапсулированные бактерии, а также Е. coli. Больные с тяжелыми формами болезни могут нуждаться в спленэктомии, которая в будущем может усилить вероятность пневмококковой инфекции.
Жалобы больного часто, даже при выраженном поражении легких, скудные. Нередко первыми симптомами легочного поражения являются высокая лихорадка и одышка.
Сбор анамнеза имеет важное, иногда решающее значение при обследовании пациента. У больных, длительно получающих иммуносупрессивную терапию препаратами, подавляющими Т-клеточный иммунитет (флюдарабин, глюкокортикоиды и т.д.), велик риск развития цитомегаловирусной или пневмоцистной пневмонии. Если инфильтративные изменения в легких возникают или прогрессируют, несмотря на лечение антибиотиками, то следует прежде всего исключить инвазию легочной ткани грибами.
Данные физикального обследования при легочном поражении могут быть малоинформативными, особенно у больных в состоянии агранулоцитоза. При аускультации не всегда выслушиваются влажные хрипы, крепитация. Иногда массивное поражение легких проявляется лишь ослабленным дыханием.
Один из первых методов инструментального обследования при поражениях легких — рентгенография, которая выполняется у всех больных при подозрении на пневмонию.
Исследование мокроты для этих целей нецелесообразно из-за возможной контаминации ее микрофлорой полости рта и особенностей воспалительного процесса в условиях нейтропении. Микроскопическое исследование мокроты является высокоспецифичным методом диагностики туберкулеза, чувствительность которого колеблется от 10 до 65%.
Выявление в мазке из мокроты при окраске по Циль-Нильсену кислотоустойчивых микобактерий и в культуре делает диагноз туберкулеза достоверным. С другой стороны, при инвазивном аспергиллезе посевы мокроты бывают положительными лишь в 8-34% случаев. При выявлении аспергилл в мокроте (микроскопия или посев) необходимо провести исследование крови на наличие антигена аспергилл (галактоманнана), КТ легких. Обнаружение очагов поражения легких при КТ и галактоманнана в крови относится к признакам, характерным для легочного аспергиллеза, и является основанием для назначения противогрибковых препаратов. В мокроте могут быть выявлены и другие микроорганизмы: нокардии — слабо грамположительные, частично кислотоустойчивые палочки; легионеллы — обнаруживаются при иммунофлюоресцентном исследовании. Выявление этих микроорганизмов в мокроте является диагностически значимым.
При этиологической верификации диагноза пневмонии результаты исследования лаважной жидкости интерпретируют следующим образом:
• диагноз бактериальной пневмонии ставят при выявлении в посеве лаважной жидкости роста диагностически значимых микроорганизмов в количестве 103 КОЕ/мл и выше. К ним относят грамположительные S. viridans, S. aureus, Enterococcus spp. и грамотрицательные Р. aeruginosa, Acinetobacterspp., Stenotrophomonas maltophilia и др. бактерии. Кандидозный генез пневмонии имеет место при обнаружении в посеве альвеолярного лаважа грибов в титре 102 КОЕ/мл и выше, а также при бактериоскопическом выявлении грибов как в бронхиальном смыве, так и в лаваже;
• обнаружение в лаважной жидкости пневмоцист подтверждает диагноз пневмоцистной пневмонии. Обнаружение или отсутствие антипневмоцистных антител в сыворотке крови не является критерием диагноза. Чувствительность исследования альвеолярного лаважа в диагностике пневмоцистной пневмонии составляет 85%;
• туберкулез легких может быть диагностирован при выявлении микобактерий в лаважной жидкости, используя окраску по Циль-Нильсену. При выявлении ДНК микобактерий методом ПЦР диагноз туберкулеза представляется вероятным, если имеется соответствующая клиническая и рентгенологическая картина и отсутствует эффект от проводимой терапии антибиотиками широкого спектра действия;
• выявление опухолевых клеток при исследовании мазка-цитоспина с большой долей вероятности свидетельствует об опухолевом поражении легких, хотя не исключает необходимость гистологического подтверждения.
У больных гемобластозами с помощью исследования альвеолярного лаважа удается установить этиологию легочных инфильтратов в 15-71% случаев, в том числе у 69% пациентов, течение гемобластоза у которых осложнилось развитием ОДН.
Если проведенное исследование не выявило причины легочного поражения, диагноз может быть поставлен с помощью биопсии легкого.
Необходимость своевременной этиологической диагностики поражения легких у онкогематологических больных не вызывает сомнений. Инфекционную патологию легких у больных в гематологической клинике необходимо дифференцировать от поражений неинфекционного генеза. Данные по этой проблеме, публикуемые зарубежными авторами, не отражают состояние проблемы в нашей стране. Это определяется различной эпидемиологической обстановкой и заболеваемостью, тактикой использования антибактериальных препаратов, режимами профилактики, диагностическими подходами. Нет единой точки зрения на видовую принадлежность бактериальной патогенной флоры, характер которой обусловлен конкретными эпидемиологическими особенностями стационара. В качестве наиболее частых возбудителей пневмонии у больных гемобластозами одни авторы называют пневмококки и легионеллы, другие — грамотрицательные аэробные бактерии (К. pneumoniae, Е. coli, Р. aeruginosa), стафилококки, негемолитические стрептококки, энтерококки. Кроме того, возбудителями могут быть микоплазмы, хламидии.
Всем больным независимо от этиологии поражения легких необходимо проводить терапию антибиотиками широкого спектра действия, которую корректируют после получения результатов бактериологического исследования лаважа, крови.
Если выделен грамноложительный возбудитель пневмонии, то препаратами выбора являются антибиотики, не являющиеся гликопептидами. К ним относятся антистафилококковые пенициллины (оксациллин), другие бета-лактамные антибиотики, триметоприм-сульфамегоксазол, тетрациклины, макролиды, клиндамицин и некоторые новые фторхинолоны (гатифлоксацин, левофлоксацин, моксифлоксацин).
Гликопептиды показаны, если выделенный микроорганизм резистентен к другим антибиотикам или у больных имеется аллергия на бета-лактамные антибиотики.
Микотические пневмонии после проведения химиотерапии больным гемобластозами выявляются в 8-16% случаях, после трансплантации гемопоэтических стволовых клеток — в 6-18%, а при развитии ОДН — в 8-14,6%. Увеличение частоты грибковых пневмоний по мере развития ОДН можно объяснить трудностями как диагностики, так и лечения грибковых инвазий легких. Из грибковых патогенов, вызывающих поражения легких, свыше 85% инфекций составляют представители 2 семейств патогенных грибов: аспергиллы (преимущественно A.flavus и A. fumigatus) и кандиды (С. albicans и другие представители Candida spp., частота выделения и спектр которых в различных стационарах различны).
В 88% случаев причиной возникновения пневмоний являются грибы рода Candida и лишь в 12% — плесневые грибы. По данным зарубежных исследователей, легочный аспергиллез у этого контингента больных выявляется в 41% случаев. Подобные различия можно объяснить разной эпидемиологической обстановкой в нашей стране и за рубежом.
Одним из важных патогенетических факторов развития грибковой инвазии является агранулоцитоз, который отмечен у 50% больных. Во время миелотоксического агранулоцитоза происходит как первичное инфицирование, так и реактивация грибковой инфекции у больных, перенесших ее ранее. Диагностика грибковой пневмонии нередко вызывает трудности при рентгенологическом исследовании. Поэтому необходимо подтверждение диагноза грибковой пневмонии бактериологически.
Основные принципы эмпирической терапии антимикотическими препаратами следующие:
• раннее применение антимикотиков (на 4-7-й дни лихорадки при нейтропении, при отсутствии нейтропении — пациентам с колонизацией Candida spp.);
• пациентам, имеющим высокий риск возникновения инвазивных микозов;
• использование препаратов с широким спектром противогрибковой активности.
Одним из основных препаратов для лечения инфекций, вызванных С. albicans, является флуконазол. Недостатком эмпирического использования флуконазола является отсутствие эффекта в отношении грибов рода Aspergillus. Второй проблемой является резистентность некоторых видов Candida spp., развивающаяся при широком использовании азоловых препаратов.
Самый частый возбудитель аспергиллеза — A.fumigatus. Заболевание могут также вызывать A. flavus,A. niger и ряд других представителей этого рода. Медикаментозное лечение проводится амфотерицином В. При выраженном иммунодефиците и глубокой длительной нейтропении прогноз крайне неблагоприятен.
Pneumocystis jiroveci (carinii) — условно-патогенный микроорганизм, обитающий в легких. Этот возбудитель отнесен к грибам. При ослабленном иммунитете он становится возбудителем пневмоцистной пневмонии. Трансплантация гемопоэтических стволовых клеток повышает вероятность возникновения пневмоцистной пневмонии, особенно в течение первых 5-6 мес. Описаны случаи развития пневмоцистной пневмонии через 3-5 лет после трансплантации костного мозга, которая возникала у больных с реакцией «трансплантат против хозяина» на фоне длительного приема кортикостероидов. В общей популяции больных гемобластозами пневмоцистная пневмония отмечена в 2% случаев. При наблюдении в течение 3 лет за больными острыми лейкозами пневмоцистная пневмония была выявлена у 24% пациентов с острым лимфобластным лейкозом и ни в одном случае среди больных острым миелобластным лейкозом. Это не означает, что пневмоцистная инфекция не встречается при миелопролиферативных опухолях. В литературе описаны единичные случаи пневмоцистной пневмонии при остром миелобластном лейкозе. Имеются сообщения о пневмоцистной инфекции у больных хроническим лимфолейкозом, лимфогранулематозом, волосатоклеточным лейкозом, лимфосаркомами, миеломной болезнью. Частота пневмоцистной пневмонии после трансплантации гемопоэтических стволовых клеток составляет от 0,7 до 15%.
Вспышки внутрибольничной инфекции среди пациентов с иммунодефицитами предполагают возможность ее передачи от человека к человеку. Инкубационный период может составлять 4-8 недель. Без лечения пневмоцистная пневмония, как правило, сопровождается нарастающей дыхательной недостаточностью, которая приводит к смерти.
При вирусных поражениях легких у пациентов с заболеваниями системы крови чаще всего выявляют ЦМВ-инфекцию. После высокодозной химиотерапии у больных гемобластозами ЦМВ-пневмония встречается в 4-8,6% случаев, что значительно реже, чем в остальных группах иммунокомпрометированных больных. По результатам аутопсий она обнаружена у 52,4% больных острым лимфобластным лейкозом.
Для диагностики ЦМВ-пневмонии используются различные способы лабораторной диагностики: обнаружение ДНК с помощью полимеразной цепной реакции, иммунофлюоресцентный метод, выделение вируса при посеве бронхоальвеолярного лаважа на однослойную микрокультуру клеток (shell vial), определение антиЦМВ антител, цитологический метод и т. д. Но ни один из них не позволяет отличить носительство ЦМВ от ЦМВ-инфекции. В проспективном исследовании у больных после трансплантации костного мозга без признаков пневмонии в 50% случаев в лаважной жидкости выявлялся ЦМВ. Поэтому, выявив ЦМВ в лаваже, врач всегда стоит перед проблемой: лечить или не лечить? Помочь ответить на этот вопрос могло бы количественное определение ЦМВ. В настоящее время имеются работы, свидетельствующие о корреляции между количеством ЦМВ, выявляемого в бронхоальвеолярном лаваже или ткани легкого, симптомами заболевания и его исходом. С помощью количественной полимеразной цепной реакции показано, что количество ДНК в лаваже у больных с ЦМВ-пневмонией в несколько раз больше, чем у больных с ЦМВ в лаваже, но без признаков пневмонии.
В настоящее время существует только два препарата, эффективных при лечении ЦМВ-инфекции — ганцикловир (цимевен) и натрия фосфоноформат (фоскавир, фоскарнет).
Вирусы простого герпеса (ВПГ-1, ВПГ-2) семейства Herpesvitidae редко являются возбудителем пневмонии. Герпетическим поражениям бронхиального дерева и легких подвержены только больные глубоким иммунодефицитом. Пневмония, возникающая при распространении герпетического трахеобронхита на паренхиму легких, носит характер некротической бронхопневмонии. При гематогенной диссеминации вируса у больных герпесом лица, полости рта, половых органов может развиваться двусторонняя интерстициальная пневмония. Герпетической пневмонии часто сопутствуют бактериальная, грибковая или протозойная пневмонии. Среди больных с ослабленным иммунитетом летальность при отсутствии противовирусной терапии превышает 80%. «Золотым стандартом» лечения герпетических инфекций дыхательных путей является ацикловир. Основной побочный эффект — преходящая почечная токсичность, вызванная выпадением препарата в осадок в почечных канальцах. Ее удается предотвратить, вводя препарат медленно и избегая обезвоживания. Учитывая дороговизну ацикловира и его аналогов, профилактику проводят только при высоком риске развития тяжелых герпетических поражений. Кроме того, следует подумать о необходимости профилактики у больных, которым планируется провести интенсивную цитостатическую и иммуносупрессивную терапию, если ранее у них отмечались клинически значимые эпизоды реактивации герпесвирусной инфекции.
Легочный туберкулез — частая инфекция у иммунокомпрометированных больных. Поражения легких могут развиться на любых этапах онкогематологических заболеваний, но его клинические проявления будут различны. При частичном подавлении клеточного иммунитета имеет место типичная картина туберкулеза легких — формирование очагов и каверн в верхних долях легких. На поздних стадиях болезни обычно наблюдается поражение нижних долей легких практически без образования каверн. Курс противотуберкулезной терапии состоит из двух этапов. Стандартный курс лечения включает двухмесячный первый этап (изониазид + рифампицин + пиразинамид) и четырехмесячный второй этап (изониазид + рифампицин). Больным туберкулезом легких, у которых возбудитель не выявлен в мокроте, срок лечения можно сократить до 4 месяцев.
Основной метод оценки эффективности лечения — бактериологический. При туберкулезе легких посев мокроты проводят ежемесячно до тех пор, пока результаты не станут отрицательными. Если результаты посева остаются положительными дольше 3 месяцев, следует заподозрить неэффективность лечения и устойчивость возбудителя к противотуберкулезным средствам. В конце курса лечения также проводят посев мокроты. При отсутствии условий для культивирования микобактерий эффективность лечения оценивают с помощью микроскопии мокроты (через 2, 5, и 6 мес. после его начала). Обнаружение в мазке возбудителей через 5 мес. — признак неэффективности лечения. Рентгенологический метод для оценки эффективности лечения использовать не рекомендуется.
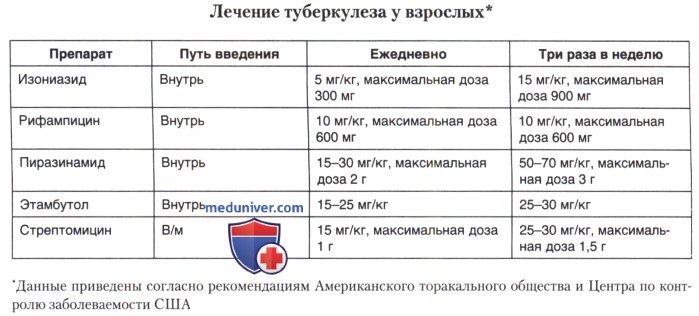
Больным с выраженной кахексией, длительное время принимающим глюкокортикоиды или другую иммуносупрессивную терапию, инфицированным лицам с активным туберкулезом показана медикаментозная профилактика. В качестве профилактического препарата используется изониазид.
Одной из причин неэффективности модифицированной терапии заболеваний легких являются инфекции, вызванные нетипичными бактериями (родов Nocardia, Legionella, Mycoplasmatales, Actinomicetes и др.).
- Читать далее "Этиология и течение сепсиса, септического шока у гематологических больных"
Редактор: Искандер Милевски. Дата публикации: 24.8.2020
- Тактика врача при диагностике инфекционных осложнений в гематологии
- Этиология и течение пневмоний у гематологических больных
- Этиология и течение сепсиса, септического шока у гематологических больных
- Этиология и течение инфекций желудочно-кишечного тракта у гематологических больных
- Этиология и течение инфекций центральной нервной системы (ЦНС) у гематологических больных
- Этиология и течение инфекций почек, мочевых путей у гематологических больных
- Этиология и течение инфекций кожи, мышц, костей у гематологических больных
- Этиология и течение синуситов у гематологических больных
- Принципы лечения инфекционных осложнений при фебрильной нейтропении
- Предупреждение внутрибольничных инфекций и профилактика инфекционных осложнений в гематологии
